I laser per il trattamento della ipertrofia prostatica (tecnica enucleativa).
- Vincenzo Scattoni
- 18 ago 2025
- Tempo di lettura: 19 min
Riassunto
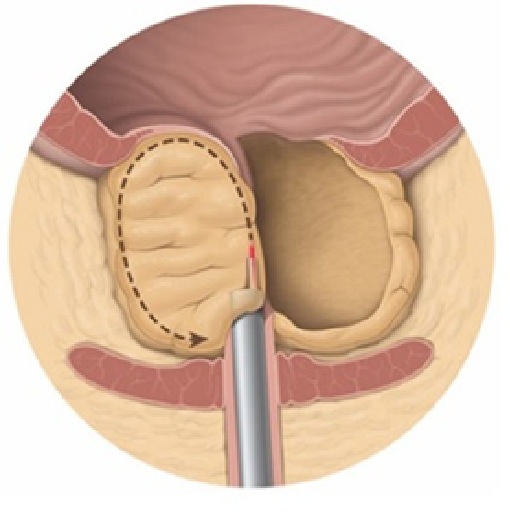
Il trattamento chirurgico della ipertrofia prostatica prevede, come suggerito dalle linee guida della Società Europea di Urologia (EAU) (come anche dalla Società americana e di molte altre nazioni) l’impiego della tecnologia laser. Il vantaggio del laser è di permettere una enucleazione anatomica (che è concettualmente diversa dalla vaporizzazione)(vedi immagine sotto e articoli correlati) del tessuto iperplastico prostatico, che determina la ostruzione al deflusso di urina, senza particolare sanguinamenti.
Il questo articolo vengo presentati i recenti progressi di tutte le tecnologie laser come il laser ad Olmio (Ho:YAG) classico, la tecnologia Moses applicata al laser ad Olmio, il laser a fibra di tullio (TFL), il laser a diodo blu e il laser ibrido.
Le tecniche di enucleazione laser della prostata che utilizzano il laser ad olmio (Ho:YAG) con tecnologia Moses e Moses 2.0, o il TFL, sembrano essere più efficienti e sicure rispetto all'enucleazione standard con classico laser ad olmio (Ho:YAG).
Fig: tecnica enucleativa
Introduzione
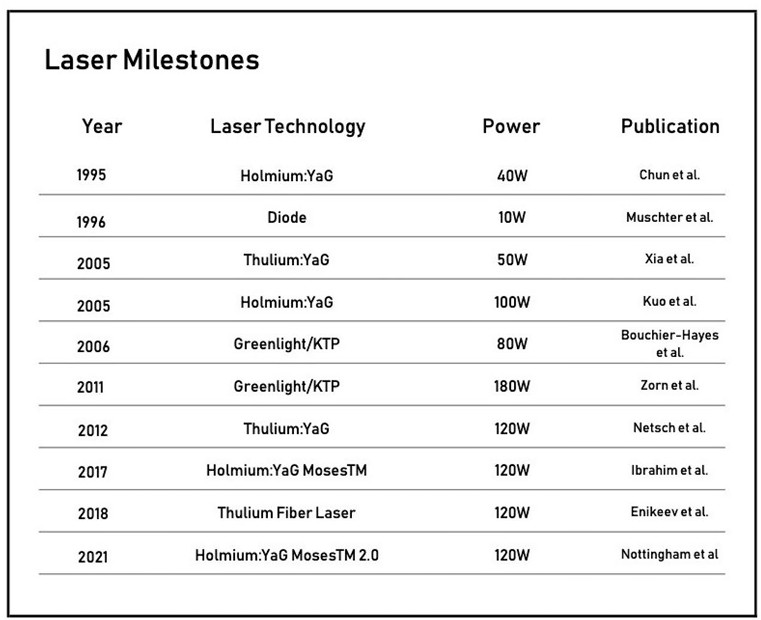
I laser sono attualmente parte integrante dell'armamentario in endourologia e possono essere utilizzati per numerose indicazioni come la litotrissia, l’ablazione, la vaporizzazione, la resezione ed enucleazione della prostata, il trattamento dei tumori uroteliali, l’endopielotomia, l’incisione delle stenosi ureterali [1–3]. Dalla sua introduzione negli anni '90, il laser a olmio (Ho:YAG), (che emette a una lunghezza d'onda di 2120 nm), è diventato il laser di riferimento in urologia grazie alla sua versatilità ed efficienza [3,4].
Da allora, sono emersi nuovi perfezionamenti e altre tecnologie laser. Attualmente, le tecnologie laser svolgono un ruolo di primo piano nella moderna gestione endoscopica dell' iperplasia prostatica benigna (IPB). L'enucleazione laser a olmio (HoLEP) è stata l'opzione terapeutica più utilizzata per decenni [3,5,6] e ha soppiantato la “vecchia” tecnica di resezione della prostata (TURP). Recentemente, è stata introdotta nella chirurgia dell'IPB, una grande varietà di laser con diverse lunghezze d'onda e potenze ottiche [3] che rendono questa tecnologia ancora più versatile e con maggiore applicazione rispetto di prima.
Laser a olmio: la tecnologia Moses.
L'utilizzo del laser ad olmio nella chirurgia della prostata è stato descritto per la prima volta nel 1996 ed oggi è diventato lo strumento standard per la chirurgia dell'IPB [3,5–8]. Il laser Ho:YAG opera a una lunghezza d'onda di 2120 nm in modalità pulsata.
PUNTI CHIAVE |
· Le tecniche di enucleazione laser della prostata che utilizzano il laser ad olmio con tecnologia Moses e Moses 2.0, o il TFL, sembrano più efficienti e sicure rispetto all'enucleazione standard “classica” con laser ad olmio.· Nessuno studio ha confrontato direttamente tutte queste nuove tecnologie (tecnologia Moses, Moses 2.0, Super Pulse TFL) tra loro e con il gold standard: l'HoLEP "standard".· Nuovi laser, tra cui laser a diodo blu e laser ibrido: attualmente sono disponibili solo dati in vitro. |
A questa lunghezza d'onda, il coefficiente di assorbimento ottico dell'acqua è di 25 cm³, prossimo al suo picco di assorbimento. Ciò significa che l'energia laser viene assorbita in modo elevato dall'acqua [9–11]. Pertanto, la profondità di penetrazione nei tessuti è di 0,4 mm e consente un'erogazione ad alta densità di energia sulla superficie tissutale. Mentre la maggior parte dei progressi nella tecnologia laser ad olmio si è concentrata sull'aumento della potenza in uscita, nel 2017 è stata introdotta una tecnologia a modulazione di impulsi, denominata "Tecnologia Moses" [12]. L'impulso laser con la tecnologia Moses è suddiviso in due parti: la prima viene utilizzata solo per creare una bolla di vapore che separa l'acqua tra la punta del laser e il bersaglio, mentre la seconda eroga direttamente la restante energia attraverso questa bolla di vapore verso il bersaglio [13]. Questa maggiore erogazione di energia determina una migliore efficienza di enucleazione, con una maggiore ablazione e separazione dei tessuti, consentendo, grazie alla forma dell'impulsi, una migliore emostasi e una dissezione più semplice del piano chirurgico.
Recenti studi clinici hanno valutato i risultati della tecnologia Moses applicata alla enucleazione dell’adenoma prostatico (la cosiddetta “MOLEP”). In uno studio retrospettivo, Whiles et al. hanno confrontato i risultati dell'ablazione laser a olmio della prostata (HoLAP) con o senza l'utilizzo della tecnologia Moses (MOLEP)[14]. Gli autori hanno riportato che il tempo di ablazione era simile tra i gruppi, ma l'efficienza dell'ablazione (grammi ablati/minuto) era aumentata con l'utilizzo della tecnologia Moses (0,91 ± 0,54 g/min senza vs 1,77 ± 1,41 g/min con la tecnologia Moses). Il tempo di cateterizzazione, la durata della degenza ospedaliera e i tassi di complicanze postoperatorie a breve termine o di reintervento erano simili tra i gruppi. Entrambi i gruppi hanno ottenuto miglioramenti comparabili nei risultati funzionali (IPSS, qualità della vita (QoL) e volume residuo post-minzionale (PVR)) a 3 mesi.
In uno studio prospettico, randomizzato, controllato, in doppio cieco, Kavoussi et al. hanno confrontato i risultati dell'HoLEP con e senza tecnologia Moses [15&&]. Sono stati inclusi pazienti con volumi prostatici superiori a 80 ml. I tempi medi di enucleazione ed emostasi sono risultati rispettivamente di 12 e 11 minuti più brevi con l'utilizzo della tecnologia Moses. La variazione postoperatoria dell'ematocrito è stata significativamente inferiore nel gruppo trattato con la tecnologia Moses. Gli autori non hanno riportato alcuna differenza nell'utilizzo di energia intraoperatoria, nella stima della perdita ematica né nel tessuto prostatico rimosso. Il tempo di cateterizzazione e la durata della degenza ospedaliera sono risultati simili tra i gruppi. Entrambi i gruppi hanno ottenuto miglioramenti comparabili nei risultati funzionali (IPSS, qualità di vita, misurazioni dell'uroflusso e PVR), nonché nelle variazioni del PSA e nei tassi di complicanze.
Un altro precedente studio retrospettivo ha riscontrato risultati comparabili [16].
Recentemente è stata rilasciata la seconda versione della tecnologia Moses, denominata "Moses 2.0". Secondo il produttore, questa tecnologia Moses 2.0 è un impulso Moses ottimizzato e consente l'utilizzo di alte frequenze > 80-120 Hz, cosa che non era possibile con la versione precedente (massimo 80 Hz). Questa nuova modulazione dell'impulso è stata sviluppata con l'intento di ottimizzare l'HoLEP, con un taglio e un'emostasi migliori. Tuttavia, attualmente non sono disponibili dati in vitro che confrontino la tecnologia Moses e Moses 2.0 sulle loro caratteristiche tecniche (durata dell'impulso, forma della bolla di vapore) e sugli effetti sui tessuti. In uno studio prospettico, randomizzato e controllato, in doppio cieco, Nevo et al. hanno confrontato i risultati dell'HoLEP con e senza Moses 2.0. Durante l'HoLEP, Moses 2.0 è stato utilizzato per l'enucleazione di un lobo prostatico, mentre il secondo lobo è stato eseguito con una modalità standard [17&]. Gli autori non hanno segnalato alcuna differenza tra il lobo destro e quello sinistro in termini di tempo di enucleazione, efficienza di enucleazione, energia totale, energia laser di enucleazione ed energia laser per l'emostasi utilizzata. In un'analisi di sottogruppo, l'utilizzo di Moses 2.0 ha comportato un tempo di enucleazione più breve (21 vs 36,7 min) e una maggiore efficienza di enucleazione (1,75 vs 1,05 g/min) rispetto alla modalità standard quando le procedure venivano eseguite da esperti. E’ stato anche riscontrato un tempo di emostasi laser più breve, con l'utilizzo di Moses 2.0, quando le procedure venivano eseguite da specializzandi.
In uno studio retrospettivo, Nottingham et al. hanno riportato un tempo di emostasi laser più breve quando gli interventi di HoLEP venivano eseguiti con Moses 2.0 rispetto a una modalità standard [18]. I risultati funzionali postoperatori, così come le complicanze, erano comparabili tra i gruppi a 3 mesi. Grazie alla migliore emostasi osservata con l'uso di Moses 2.0, gli autori hanno modificato la loro pratica chirurgica, passando a un intervento chirurgico con dimissioni in giornata nel 70% dei casi di HoLEP eseguiti con questa nuova tecnologia.
Laser a fibra di tulio (TFL)(ThuFLEP)
Il TFL, che non deve essere confuso con il laser a tullio:YAG a onda continua, opera a una lunghezza d'onda di 1940 nm in modalità continua o pulsata con una fibra laser a fuoco frontale. Recentemente, è stato introdotto sul mercato il TFL Super Pulse [19]. A questa lunghezza d'onda, il coefficiente di assorbimento ottico dell'acqua è di 120 cm³ (quattro volte superiore rispetto al laser Ho:YAG), che rappresenta il suo picco di assorbimento massimo [9–11]. La conseguenza teorica di ciò è che una maggiore energia del TFL viene assorbita dalle cellule, con conseguente migliore ablazione. Pertanto, la profondità di penetrazione tissutale è di 0,2 mm. Studi in vitro hanno riportato profondità di incisione e coagulazione maggiori in modalità a onda continua rispetto a quella pulsata [20–22]. A parità di potenza, è stata riscontrata una carbonizzazione pronunciata in modalità a onda continua. In base a questi risultati, si presume che il Super Pulse TFL abbia proprietà di coagulazione inferiori rispetto al TFL a onda continua. Gli studi inclusi in questa revisione riportano risultati ottenuti solo con il TFL a onda continua. Attualmente, nessuno studio clinico ha valutato il nuovo Super Pulse TFL.
L'enucleazione laser a fibre di tulio (ThuFLEP) è stata descritta per la prima volta nel 2018 in uno studio retrospettivo che confrontava tre tecniche di enucleazione: HoLEP, ThuFLEP ed enucleazione monopolare della prostata (MEP) [23]. Gli autori hanno riportato che i tempi di enucleazione erano più brevi con le tecniche laser rispetto alla MEP. Il tempo di cateterizzazione e la degenza ospedaliera erano significativamente più brevi e la perdita di sangue significativamente inferiore dopo le tecniche di enucleazione laser rispetto alla MEP. Per le tre tecniche, i risultati funzionali (IPSS, QoL, Qmax e PVR) erano comparabili a 6 mesi. Ad eccezione del sanguinamento postoperatorio che richiedeva un'irrigazione vescicale prolungata dopo la MEP rispetto alle tecniche di enucleazione laser, i tassi di complicanze erano simili. Questo studio ha concluso che la ThuFLEP aveva risultati simili alla HoLEP ed era un'alternativa alla HoLEP. Uno studio randomizzato incentrato sulle curve di apprendimento di queste tre tecniche ha riscontrato risultati simili [24]. In uno studio prospettico randomizzato, Enikeev et al. hanno confrontato ThuFLEP con TURP monopolare per il trattamento di prostate di volume <80 mL [25&&]. Il tempo operatorio è stato significativamente maggiore nel gruppo ThuFLEP rispetto a quello TURP (46,6 ± 10,2 vs 39,9 ± 8,6 min). Il tempo di cateterizzazione è stato significativamente inferiore dopo ThuFLEP rispetto a TURP (1,4 vs 2,4 giorni). La riduzione dell'emoglobina è stata significativamente inferiore nel gruppo ThuFLEP rispetto al gruppo TURP (1,01 vs 1,8 g/dL). Entrambi i gruppi hanno ottenuto miglioramenti comparabili nei risultati funzionali (IPSS, QoL, Qmax e PVR) e nei tassi di complicanze a 12 mesi.
Poiché il trattamento chirurgico degli uomini con prostate di dimensioni superiori a 80 ml era tradizionalmente limitato alla prostatectomia a cielo aperto, lo stesso gruppo ha confrontato in uno studio retrospettivo la ThuFLEP con la prostatectomia a cielo aperto per prostate di dimensioni superiori a 80 ml [26]. Il tempo di cateterizzazione e la degenza ospedaliera sono risultati significativamente più brevi, e la perdita di sangue e la necessità di trasfusioni di sangue significativamente inferiori dopo la ThuFLEP rispetto alla prostatectomia a cielo aperto. I risultati funzionali (IPSS, QoL, Qmax e PVR) erano comparabili. La più ampia esperienza monocentrica, che comprendeva 1413 pazienti trattati con HoLEP, ThuFLEP o MEP in un arco di tempo di 5 anni, non ha riportato significative differenze nei tassi di complicanze intraoperatorie, postoperatorie e a 6 mesi di follow-up [27&]. Poiché la funzione erettile può essere influenzata dal trattamento chirurgico per l'IPB, Enikeev et al, in uno studio retrospettivo, hanno confrontato i cambiamenti postoperatori della funzione erettile, tra ThuFLEP e resezione transuretrale monopolare della prostata (TURP) [28]. La funzione erettile dopo ThuFLEP è rimasta stabile nel 56% dei pazienti, è migliorata nel 26% e è peggiorata nel 18%. Non si è verificata alcuna disfunzione erettile de novo nei pazienti trattati con ThuFLEP. La funzione erettile dopo TURP è rimasta stabile nel 43% dei pazienti, è migliorata nel 21% e si è peggiorata nel 36%. Molti studi hanno riportato che la HoLEP è una tecnicamente impegnativa, con una curva di apprendimento ripida [29]. Per questo motivo, uno studio randomizzato alcuni autori ha confrontato le curve di apprendimento con ThuFLEP, HoLEP e MEP (associate a un tutoraggio) per il trattamento di pazienti con volume prostatico <80 mL [24]. Gli autori hanno dimostrato che la ThuFLEP tendeva ad essere associata a una curva di apprendimento più breve rispetto a HoLEP e MEP.
Laser a diodo blu
I laser a diodo sono laser a semiconduttore. Attualmente, esistono diversi laser a diodo, che operano in modalità continua a diverse lunghezze d'onda. Il laser a diodo blu opera a una lunghezza d'onda di 450 nm, alla quale l'energia del laser viene fortemente assorbita dall'emoglobina e dalla melanina, ma non dall'acqua [30]. Infatti, il sangue ha uno spettro di assorbimento massimo a 430 nm [31]. I coefficienti di assorbimento ottico dell'emoglobina allo spettro verde a 532 nm e allo spettro blu a 450 nm sono simili, in un intervallo di circa 200 cm³ [30]. Inoltre, la profondità di penetrazione tissutale della luce blu è inferiore a quella dei laser a infrarossi [30]. Pertanto, il laser a diodo blu potrebbe rappresentare un'alternativa al laser verde nell'ablazione e nella coagulazione dei tessuti molli. Descritto per la prima volta nel 2015 in chirurgia dentale per ridurre la colonizzazione batterica, coagulare e tagliare i tessuti molli, questo laser era a bassa potenza (2W) [32,33]. Attualmente, non esiste uno studio clinico che valuti il laser a diodo blu in urologia. Sono stati pubblicati solo studi in vitro che hanno indagato le interazioni laser-tessuto del laser a diodo blu [22,34,35].
Laser ibrido
Il laser ibrido combina due laser con diverse lunghezze d'onda: uno ha il suo massimo assorbimento nell'acqua e l'altro ha il suo massimo assorbimento nell'emoglobina. Attualmente, questo laser ibrido è ancora un prototipo e combina un TFL a onda continua (1940 nm) con un laser a diodo blu (450 nm). L'obiettivo di tale laser è combinare le capacità di taglio del TFL con le proprietà di coagulazione del laser a diodo blu. Infatti, l'energia laser viene assorbita dal tessuto attraverso i suoi cromofori, che nella prostata sono acqua ed emoglobina. In uno studio in vitro, Becker et al. hanno confrontato questo laser con un laser Ho:YAG e un TFL a onda continua sulle interazioni laser-tessuto attraverso incisioni su campioni di rene suino fresco non congelato [36]. Hanno riferito che il laser ibrido presentava la profondità di incisione più profonda tra i laser testati, con uno spostamento della fibra laser di 7,3 ± 0,1 mm a 2 mm/s. La zona di coagulazione era più piccola rispetto agli altri laser. L'analisi microscopica ha mostrato incisioni profonde e strette con margini netti e minima carbonizzazione. Analogamente al laser a diodo blu, le prove rimangono limitate e sono necessari ulteriori studi.
Commento sulle tecniche di enucleazione con i nuovi laser
Questa revisione ha dimostrato che le tecniche di enucleazione laser della prostata utilizzando il laser ad Olmio con la tecnologia Moses e Moses 2.0, o il TFL, sembrano efficienti e sicure rispetto all'enucleazione standard utilizzando il laser ad Omio tradizionale. Tuttavia, tra gli studi inclusi, solo pochi presentavano un elevato livello di evidenza e mancano dati a lungo termine. Il crescente numero di tipi di laser e i perfezionamenti tecnologici possono creare confusione e le prove a supporto delle diverse tecnologie laser variano sostanzialmente. Negli studi inclusi, solo uno studio clinico randomizzato controllato ben progettato, che ha confrontato i risultati dell'HoLEP con e senza tecnologia Moses, ha riscontrato un vantaggio della tecnologia Moses sui tempi medi di enucleazione ed emostasi. I risultati funzionali e i tassi di complicanze erano simili tra le due tecniche [15&&]. Il tempo di emostasi più breve riscontrato in quattro studi con la tecnologia Moses e Moses 2.0 è stato interpretato come una migliore coagulazione [15&&,16,17&,18]. Una recente meta-analisi ha concluso che l'HoLEP con tecnologia Moses offre risultati migliori in termini di risultati intraoperatori rispetto all'HoLEP tradizionale. Gli autori hanno riscontrato tempi di enucleazione, emostasi e tempi chirurgici totali più brevi a parità di energia erogata. Tuttavia, è difficile valutare il reale impatto clinico di tale risultato [37&&].
Nessuno studio ha confrontato tutte queste nuove tecnologie (tecnologia Moses, Moses 2.0, Super Pulse TFL), già utilizzate nella pratica, tra loro e con il gold standard: l'HoLEP "standard". Inoltre, sono necessari studi ben progettati che valutino queste tecnologie su specifici gruppi di pazienti a rischio e la durabilità a lungo termine dei risultati. Sarà necessario uno studio che valuti anche le curve di apprendimento di queste tecnologie, poiché l'enucleazione laser della prostata è indicata come una procedura complessa con una curva di apprendimento ripida [29]. Pertanto, non si può trarre alcuna conclusione a favore di una tecnologia rispetto all'altra. Per quanto riguarda le due nuove tecnologie laser, il laser a diodo blu e il laser ibrido, sono attualmente disponibili solo dati in vitro. Il laser a diodo blu, con emoglobina come cromoforo, ha mostrato una profondità di incisione intermedia e una profondità di coagulazione minima rispetto al laser Ho:YAG e al Super Pulse TFL [22]. Il laser ibrido, con acqua ed emoglobina come cromofori, ha mostrato una profondità di incisione elevata e un'area di coagulazione ridotta rispetto al laser Ho:YAG e al TFL a onda continua [36]. Questi dati sono preliminari e limitati dal design in vitro che utilizza modelli non perfusi. Pertanto, tali risultati non possono essere tradotti in risultati in vivo. Sono necessari studi clinici per definire il ruolo di tali laser.
lI laser verde (GreenLight™)
Dovendo parlare di laser è quasi d’obbligo accennare anche ad un ad una tecnica laser che è stata molto impiegata in passato. Questa tecnica non viene più utilizzata così ampiamente perché prevede la fotovaporizzazione della prostata (PVP) e non la enucleazione, che, in tutti gli studi clinici, si è dimostrata essere superiore alla vaporizzazione [38].
La fotovaporizzazione, anche nota come GreenLight™ (laser verde), prevede il passaggio di un laser al neodimio:YAG attraverso un cristallo diverso per raddoppiare la frequenza e dimezzare la lunghezza d'onda a 532 nm, che corrisponde alla luce verde nello spettro della luce visibile [38]. Questa lunghezza d'onda è ben assorbita dall'emoglobina e non dall'acqua [39]. Pertanto, ha una profondità di assorbimento molto breve nel tessuto prostatico ben vascolarizzato [38]. Viene utilizzato senza contatto per causare l'immediata vaporizzazione del tessuto prostatico ed è praticamente privo di sangue [38]. La successiva necrosi tissutale e l'edema al di sotto del tessuto vaporizzato sono minimi e non problematici [38]. I laser di prima generazione emettevano un laser Nd:YAG da 80 W attraverso un cristallo di potassio, titanil-fosfato (KTP) [40]. Le generazioni successive emettevano un laser Nd:YAG attraverso un cristallo di triborato di litio (LBO), ottenendo nuovamente una lunghezza d'onda di 532 nm, ma questi sistemi più recenti avevano una potenza maggiore (120 W HPS™ nel 2006 e 180 W XPS™ nel 2010) [40].
In pratica, la PVP utilizza un laser a emissione laterale per vaporizzare il tessuto prostatico fino alla capsula chirurgica [40]. Pertanto, non vi è tessuto da inviare per l'esame istologico. Le linee guida AUA attualmente consigliano la PVP come opzione terapeutica per gli uomini con IPB e prostate piccole (<30 cc) o medie (30-80 cc). Il Global Greenlight Group (GGG) ha recentemente valutato la PVP nelle prostate >80 cc valutando retrospettivamente 3441 pazienti sottoposti a PVP tra il 2011 e il 2019. Hanno confrontato i risultati degli uomini con prostate <80 cc con quelli con prostate >80 cc. I loro risultati hanno dimostrato un calo significativamente maggiore del punteggio IPSS a 12 mesi nei soggetti con prostate >80 cc e tassi simili di trasfusioni, ematuria e ricoveri in giornata. Hanno concluso che la PVP per le prostate di grandi dimensioni sembra essere un'alternativa sicura ed efficace con risultati duraturi [41]. Tuttavia, la PVP per prostate di dimensioni superiori a 40 cc richiede più tempo rispetto ad altre tecniche laser [42&].
Anche il laser verde è stato impiegato ed adatto per eseguire la tecnica enucleativa (GreenLep). Nguyen et al. hanno valutato i tempi operatori per diverse procedure per l'iperplasia prostatica benigna (IPB) e hanno osservato che la relazione tra il tempo della procedura e le dimensioni della prostata era di 0,32 min/g per l'enucleazione GreenLight™ della prostata (GreenLEP), 0,28 min/g per HoLEP, 0,32 min/g per ThuLEP e 0,63 min/g per la PVP [29&]. È importante notare che la GreenLEP è stata studiata e si è dimostrata sicura ed efficace [29&]. Rispetto alla PVP, la GreenLEP offre tempi operatori più rapidi e tassi di reintervento inferiori, sebbene entrambe sembrino sicure ed efficaci [43]. Anche la vapoenucleazione prostatica Greenlight ha dimostrato di essere sicura e non inferiore alla HoLEP standard [31].
Conclusioni
L'urologo moderno ha la fortuna di avere a disposizione una miriade di laser eccellenti, che possono essere utilizzati per una varietà di tecniche chirurgiche sicure ed efficaci nel trattamento dell'iperplasia prostatica benigna (IPB). Nell'era attuale, la questione di quale sia il "laser migliore" sembra meno rilevante, poiché molti laser si sono dimostrati sicuri ed efficaci. Quello che emerge dalla esperienza clinica è, piuttosto, la superiorità della tecnica enucleativa rispetto a fotovaporizzazione o alla resezione. I progressi futuri potrebbero portare alla creazione di un laser davvero superiore, ma per ora la preferenza del chirurgo gioca il ruolo principale nella decisione di quale laser utilizzare per il trattamento dell'IPB, mentre i risultati sembrano dipendere di più dalla tecnica e dalla esperienza del chirurgo. Il trattamento chirurgico dell'IPB con le nuove tecnologie (Moses, Moses 2.0 e TFL) mostra risultati incoraggianti, paragonabili al trattamento standard. Sono necessari futuri studi ben progettati che confrontino queste tecnologie e le valutino su specifici gruppi di pazienti a rischio e sulla durabilità a lungo termine dei risultati.
REFERENCES AND RECOMMENDED READING
Papers of particular interest, published within the annual period of review, have been highlighted as:
Ø & of special interest
Ø && of outstanding interest
1. Fried NM. Recent advances in infrared laser lithotripsy [Invited]. Biomed OptExpress 2018; 9:4552–4568.
2. Fried NM, Irby PB. Advances in laser technology and fibre-optic delivery systems in lithotripsy. Nat Rev Urol 2018; 15:563–573.
3. Herrmann TR, Liatsikos EN, Nagele U, et al. EAU Guidelines on lasers and technologies 2014.
4. Johnson DE, Cromeens DM, Price RE. Use of the holmium:YAG laser in urology. Lasers Surg Med 1992; 12:353–363.
5. Gravas S, Cornu JN, Gacci M, et al. EAU Guidelines on management of nonneurogenic male LUTS 2021.
6. Lerner LB, McVary KT, Barry MJ, et al. Management of lower urinary tract symptoms attributed to benign prostatic hyperplasia: AUA GUIDELINE PART II-Surgical Evaluation and Treatment. J Urol 2021; 206:818–826.
7. Gilling PJ, Cass CB, Cresswell MD, et al. Holmium laser resection of the prostate: preliminary results of a new method for the treatment of benign prostatic hyperplasia. Urology 1996; 47:48–51.
8. Gilling PJ, Cass CB, Cresswell MD, et al. The use of the holmium laser in the treatment of benign prostatic hyperplasia. J Endourol 1996; 10:459–461.
9. Hale GM, Querry MR. Optical constants of water in the 200-nm to 200- microm wavelength region. Appl Opt 1973; 12:555–563.
10. Jansen ED, van Leeuwen TG, Motamedi M, et al. Temperature dependence of the absorption coefficient of water for midinfrared laser radiation. Lasers SurgMed 1994; 14:258–268.
11. Lange BI, Brendel T, Huttmann G. Temperature dependence of light absorption in water at holmium and thulium laser wavelengths. Appl Opt 2002; 41:5797–5803.
12. Elhilali MM, Badaan S, Ibrahim A, et al. Use of the moses technology to improve holmium laser lithotripsy outcomes: a preclinical study. J Endourol 2017; 31:598–604.
13. Ventimiglia E, Traxer O. What is moses effect: a historical perspective. J Endourol 2019; 33:353–357.
14. Whiles BB, Martin AJ, Brevik A, et al. Utilization of MOSES modulated pulse mode results in improved efficiency in holmium:YAG laser ablation of the prostate. Urology 2021; 149:187–192.
15. && Kavoussi NL, Nimmagadda N, Robles J, et al. MOSES(TM) technology for holmium laser enucleation of the prostate: a prospective double-blind randomized controlled trial. J Urol 2021; 206:104–108. (A randomized controlled trial comparing the outcomes of HoLEP with and without Moses technology. Advantage of Moses technology on mean enucleation and hemostasis times.)
16. Large T, Nottingham C, Stoughton C, et al. Comparative study of holmium laser enucleation of the prostate with MOSES enabled pulsed laser modulation. Urology 2020; 136:196–201.
17. & Nevo A, Faraj KS, Cheney SM, et al. Holmium laser enucleation of the prostate using Moses 2.0 vs non-Moses: a randomised controlled trial. BJU Int 2021;127:553–559. (Randomized controlled trial comparing the outcomes of HoLEP with and without Moses 2.0.)
18. Nottingham CU, Large T, Agarwal DK, et al. Comparison of newly optimized moses technology vs standard holmium:YAG for endoscopic laser enucleation of the prostate. J Endourol 2021; 35:1393–1399.
19. Traxer O, Keller EX. Thulium fiber laser: the new player for kidney stone treatment? A comparison with Holmium:YAG laser. World J Urol 2020; 38:1883–1894.
20. Becker B, Enikeev D, Glybochko P, et al. Effect of optical fiber diameter and laser emission mode (cw vs pulse) on tissue damage profile using 1.94 microm Tm:fiber lasers in a porcine kidney model. World J Urol 2020; 38:1563–1568.
21. Taratkin M, Kovalenko A, Laukhtina E, et al. Ex vivo study of Ho:YAG and thulium fiber lasers for soft tissue surgery: which laser for which case? Lasers Med Sci 2020.
22. Taratkin M, Netsch C, Enikeev D, et al. The impact of the laser fiber-tissue distance on histological parameters in a porcine kidney model. World J Urol 2020.
23. 23. Enikeev D, Glybochko P, Okhunov Z, et al. Retrospective analysis of shorter outcomes after monopolar versus laser endoscopic enucleation of the prostate: a single center experience. J Endourol 2018; 32:417–423.
24. Enikeev D, Glybochko P, Rapoport L, et al. A randomized trial comparing the learning curve of 3 endoscopic enucleation techniques (HoLEP, ThuFLEP, and MEP) for BPH Using Mentoring Approach-Initial Results. Urology 2018; 121:51–57.
25. && Enikeev D, Netsch C, Rapoport L, et al. Novel thulium fiber laser for endoscopic enucleation of the prostate: a prospective comparison with conventional transurethral resection of the prostate. Int J Urol 2019; 26:1138–1143. (Prospective randomized study comparing ThuFLEP to monopolar TURP for the treatment of prostates < 80 mL.)
26. Enikeev D, Okhunov Z, Rapoport L, et al. Novel thulium fiber laser for enucleation of prostate: a retrospective comparison with open simple prostatectomy. J Endourol 2019; 33:16–21.
27. & Morozov A, Taratkin M, Kozlov V, et al. Retrospective assessment of endoscopic enucleation of prostate complications: a single-center experience of more than 1400 patients. J Endourol 2020; 34:192–197. The largest single-centre experience encompassing 1413 patients treated with HoLEP, ThuFLEP, or MEP within a time span of 5 years.
28. Enikeev D, Glybochko P, Rapoport L, et al. Impact of endoscopic enucleation of the prostate with thulium fiber laser on the erectile function. BMC Urol 2018; 18:87.
29. Brunckhorst O, Ahmed K, Nehikhare O, et al. Evaluation of the learning curve for holmium laser enucleation of the prostate using multiple outcome measures. Urology 2015; 86:824–829.
30. Vogel A, Venugopalan V. Mechanisms of pulsed laser ablation of biological tissues. Chem Rev 2003; 103:577–644.
31. Ishikawa I, Okamoto T, Morita S, et al. Blue-violet light emitting diode (LED) irradiation immediately controls socket bleeding following tooth extraction: clinical and electron microscopic observations. Photomed Laser Surg 2011; 29:333–338.
32. Braun A, Kettner M, Berthold M, et al. Efficiency of soft tissue incision with a novel 445-nm semiconductor laser. Lasers Med Sci 2018; 33:27–33.
33. Fornaini C, Merigo E, Rocca JP, et al. 450nm blue laser and oral surgery: preliminary ex vivo study. J Contemp Dent Pract 2016; 17:795–800.
34. Jiang DL, Yang Z, Liu GX, et al. A novel 450-nm blue laser system for surgical applications: efficacy of specific laser-tissue interactions in bladder soft tissue. Lasers Med Sci 2019; 34:807–813.
35. Xu X, Jiang D, Liu G, et al. In vitro evaluation of the safety and efficacy of a highpower 450-nm semiconductor blue laser in the treatment of benign prostate hyperplasia. Lasers Med Sci 2021.
36. Becker B, Enikeev D, Netsch C, et al. Comparative analysis of vaporization and coagulation properties of a hybrid laser (combination of a thulium and blue diode laser) vs thulium and Ho:YAG lasers: potential applications in endoscopic enucleation of the prostate. J Endourol 2020; 34:862–867.
37. && Gauhar V, Gilling P, Pirola GM, et al. Does MOSES technology enhance the efficiency and outcomes of standard holmium laser enucleation of the prostate? Results of a systematic review and meta-analysis of comparative studies. Eur Urol Focus 2022. (Meta-analysis reporting HoLEP using Moses technology performs better in terms of intraoperative outcomes (shorter enucleation, hemostasis, and total surgical times) when compared to traditional HoLEP.)
38. Zarrabi A, Gross AJ. The evolution of lasers in urology. Ther Adv Urol. 2011;3(2):81–9. https:// doi. org/ 10. 1177/ 17562 87211 400494.
39. Bachmann A, Ruszat R. The KTP-(greenlight-) laser–principles and experiences. Minim Invasive Ther Allied Technol. 2007;16(1):5–10. https:// doi. org/ 10. 1080/ 13645 70060 11578 85.
40. Zorn KC, Liberman D. GreenLight 180W XPS photovaporiza tion of the prostate: how I do it. Can J Urol. 2011;18(5):5918–26.
41. Corsi N, Nguyen DD, Arezki A, Sadri I, Law K, Bouhadana D, Deyirmendjian C, Bhojani N, Elterman DS, Bruyère F, Cindolo L, Ferrari G, Vasquez-Lastra C, Borelli-Bovo T, Becher EF, Cash H, Reimann M, Rijo E, Misrai V, Chughtai B, Zorn KC. Functional outcomes of GreenLight 180-W photoselective vaporization in patients with large (≥ 80 cc) prostates: an analysis of over 3000 men in the Global Greenlight Group (GGG) database. World J Urol. 2023;41(2):529–36. https:// doi. org/ 10. 1007/ s00345- 022- 04260-4.
42. & Nguyen DD, Misraï V, Bach T, Bhojani N, Lingeman JE, Elterman DS, Zorn KC. Operative time comparison of aquab lation, Greenlight PVP, ThuLEP, GreenLEP, and HoLEP. World J Urol. 2020;38(12):3227–33. https:// doi. org/ 10. 1007/ s00345- 020- 03137-8. (This interesting study compares operative times for various surgical techniques used to treat BPH. In regard to laser technology, it demonstrates that surgical technique plays a role in operative efficiency).
43. Gasmi A, Khene ZE, Guérin S, Bensalah K, Peyronnet B, Mathieu R, Roupret M, Rijo E, Pradère B, Misrai V. Propensity score analysis comparing perioperative and functional outcomes between XPS 180 W-photovaporization and GreenLight laser enucleation of the prostate: reasons to discard vaporization and move to enucleation. World J Urol. 2021;39(7):2269–76. https:// doi. org/ 10. 1007/ s00345- 021- 03590-z.







Commenti